Re: [新聞] AZ代工「有人」不太喜歡是誰? 阿中:想也知道 不用再說
※ 引述《LukeSkywaker (路克天醒者)》之銘言:
: 1.媒體來源:自由時報LTN
: 2.記者署名:2021/06/11 12:08〔記者陳昀/台北報導〕
: 3.完整新聞標題:
: AZ代工「有人」不太喜歡是誰? 阿中:想也知道 不用再說
: 4.完整新聞內文:
: https://img.ltn.com.tw/Upload/news/600/2021/06/11/phplnF8BR.jpg
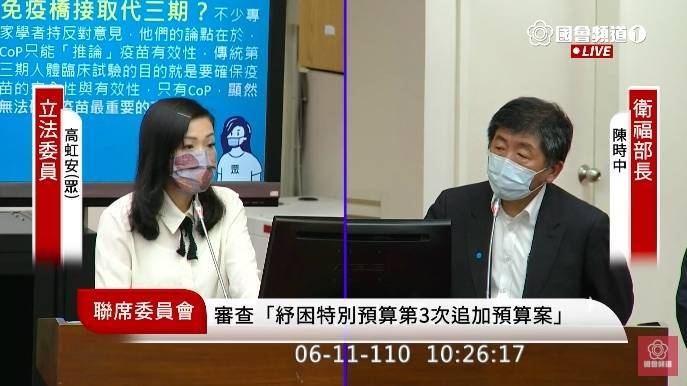
: 衛福部長陳時中昨表示曾和AZ研發團隊談授權製造,沒有談成,不是台灣不願意,且「也
: 有人不太喜歡」,另方面是產量有困難,立委高虹安今追問「有人」是誰,陳時中表示,
: 「你想你也知道,我也不用再說」,並強調這都是外力的影響,但最主要還是因為跟不上
: 那麼大的量。(圖擷取自國會頻道)
: 2021/06/11 12:08
: 〔記者陳昀/台北報導〕中央流行疫情指揮中心指揮官、衛福部長陳時中昨在立法院財政
: 委員會聯席審查紓困4.0預算時表示,曾和AZ研發團隊談授權製造,沒有談成,不是台灣
: 不願意,且「也有人不太喜歡」,另方面是產量有困難,今被追問「有人」是誰,陳時中
: 表示,「你想你也知道,我也不用再說」,並強調這都是外力的影響,但最主要還是因為
: 跟不上那麼大的量。
: 立法院財政委員會今繼續審查紓困4.0預算,民眾黨立委高虹安詢問陳時中,所謂有人不
: 太喜歡的「有人」是誰?陳回應「有人,你想你也知道,我也不用再說。」對於高要求明
: 確回答,陳時中表示,明確地講,是量能上沒辦法提供這麼大的劑量,委員不用故意這樣
: ,這都是外力的影響。
: 不過,高質疑,為什麼會有外力能影響我們放棄代工策略?陳說:「我沒有說因為這樣而
: 放棄,我是說也有人不喜歡,最主要是量,我沒辦法跟上那麼大的量。」高則提醒,這句
: 話有很大想像空間,請陳時中發言要審慎。
: 此外,美國食品藥物管理局FDA將疫苗解盲的審查過程以線上會議全程直播,高虹安盼我
: 比照辦理、消除國人疑慮,陳時中表示,要看食藥署要跟審查委員有沒有提出或想這樣做
: ,尊重審查委員會。
: 對於高虹安說「請您承諾」,陳反駁,不要請我承諾,世界哪個國家這樣做呢?目前沒有
: 這樣的打算,大部分國家都沒這樣做,原則上委員能在不受外界對立壓力上,在學術上做
: 完整探討,反而會產生比較公正的結果。
: 高虹安批評,不想提舊事,但3+11一直沒有會議紀錄,是國人對指揮中心沒信心的原因之
: 一,陳時中聞言回擊「我已經講過這件事我負責,我們有一定程序,不然委員可以說指揮
: 中心每場會議都直播,那我們什麼事都不用辦了」。
: 高不甘示弱表示,部長不用曲解發言,她是說審查會議需要真相,但陳再解釋,他已公開
: 表達3+11有經過一定會議程序與政策面報,再由他下決定,「請不要一直拿這樣的東西污
: 蔑我們」。
: 5.完整新聞連結 (或短網址):
: https://news.ltn.com.tw/news/life/breakingnews/3566311
: https://upload.cc/i1/2021/06/11/jRSt4n.jpg

疫苗是對抗COVID-19的終極手段,多國與時間賽跑,搶先進入臨床試驗階段。圖為倫敦的
一家診所正準備為志願測試者施打COVID-19疫苗。(攝影/AP Photo/Kirsty
Wigglesworth/達志影像)
全球近2千萬人遭感染的COVID-19(亦稱武漢肺炎、新冠肺炎)疫情持續在高峰,疫苗被認
為是唯一能真正有效阻卻疫情的終極手段,目前進度最快的包括牛津大學(Oxford
University)與英國藥廠阿斯特捷利康公司(AstraZeneca)合作開發的「AZD1122」;已
宣布定價在32~37美元的美國生物科技公司莫德納(Moderna)「mRNA-1273」;德國生技藥
廠BioNTech、美國輝瑞藥廠(Pfizer)及法國疫苗大廠Valneva組成疫苗聯盟開發的「
BNT162」;中國康希諾生物和中國軍事科學院聯合開發的重組疫苗「Ad5-nCoV」,都將進
入第三期臨床試驗,最快年底即可上巿。
全世界都在力拼今年秋冬接種疫苗。行政院和衛福部亦早籌組「疫苗國家隊」備戰,但本
土藥廠國光、聯亞8月中才展開人體試驗,進度已落後全球,行政院近日再透過國家衛生研
究院積極爭取英國牛津大學疫苗授權 「AZD1122」 在台生產。看似「雙保險」,然而,一
旦成功爭取牛津授權,疫苗將由台康生技「代工」;台康也是本土疫苗的代工廠,當本土
疫苗臨床試驗在即,卻面臨可能找不到代工廠生產的窘境,替外廠代工和本土研發恐引發
排擠效應。
疫苗政策布局缺乏全面性、法規政策也慢半拍,疫苗國家隊的召集人、前疾管局(現改制
疾病管制署)局長蘇益仁上月掛冠求去,他接受《報導者》採訪時憂心,台灣沒有把流行
病學和全球局勢一起考慮,疫苗政策只炒短線,一旦兩頭空,長遠防疫如同走鋼索。
(2020.9.9更新:牛津疫苗「AZD1122」 全面暫停第三期臨床試驗)
「我無法否認(此事)!」
《報導者》向中央流行疫情指揮中心發言人、疾管署副署長莊人祥查證,國衛院是否已和
牛津大學接觸,爭取年底前獲得授權、由台康生技在台灣代工生產百萬劑疫苗,供國人使
用?他表示,確實已經提出申請,但提出什麼資料、申請進度等,因為一切還在進行中,
無法對外透露。莊人祥語帶曖昧並強調,「再多說,合約就走不下去了,希望最近有消息
。」
牛津大學和阿斯特捷利康公司(AstraZeneca ,簡稱AZ)合作開發的「AZD1222」採創新的
平台,承諾不尋求獲利,以成本價發售,並與世界各地合作夥伴廣泛建立供應鏈,保證盡
可能廣泛而公平地供應疫苗給最多的國家,設計產能為20億劑,對美國的供貨價格一劑僅
約4美元、中低收入國家則約2.5美元。除了美、英、德、荷等國,日本、中國近日也陸續
宣布和AZ完成授權簽署。
據了解,國衛院7月即接受行政院指示,積極和AZ展開接觸。國衛院今(8月10日)到衛福
部召開記者會,宣布正在研發的DNA疫苗在動物試驗證明具保護效果,《報導者》當面向國
衛院院長梁賡義詢問是否亦在處理AZ授權一事?他僅表示:「要問指揮中心。」
衛福部和國衛院態度如此低調,除國際合作相關條款需保密外,也因以代工方式在台產製
,對本土疫苗研發時程和布局恐形成排擠效 應;有意藉此波COVID-19提升產業層次、蓄積
研發能量的本土生技業,對政策引導再走回頭路,停在「代工」老路,出現反彈。
有業者認為,防疫為重,購買國外疫苗備戰,當然是必要的;但若先去替國外廠代工,影
響層面就較大,因為國內生產線有限,如此會犧牲本土疫苗的進程和量能, 「這是政府對
國內生技業沒有信心。」
這也同樣反映在本土快篩試劑上,連扶植產業的經濟部也無奈。之前工研院研發的本土分
子快篩工具,雖取得專案製造核可,「但疫情指揮中心不敢用。」一名參與研發過程的經
濟部官員私下透露,「當本土研發不被重視,怎麼能帶動台灣生技產業發展?」
政府急搶牛津授權代工,本土廠商憂排擠生產量能
https://i.imgur.com/uBOPMkk.png

國家實驗動物中心是台灣實驗動物的培育重鎮,此次新冠病毒多項實驗選用倉鼠進行動物
實驗。圖為培育一般小鼠的動物房。(攝影/余志偉)
目前國內共有4家廠商研發COVID-19疫苗,包括國光生技、高端、聯亞生技以及國光生技旗
下子公司安特羅,其中國光和聯亞進度較快,預計8月開始第一期人體試驗。
國衛院今宣布,與安特羅合作的DNA疫苗,動物試驗證明具保護效果,接種疫苗的倉鼠再去
感染COVID-19後,肺臟病毒量下降,體重和活動力也沒有受到明顯影響;而沒打疫苗的染
病倉鼠,體重下降了10%,病毒量是有打疫苗倉鼠的100倍。國衛院感染症與疫苗研究所長
廖經倫表示,這支疫苗除COVID-19外,可能連帶對其他冠狀病毒家族有保護效果,「非常
值得發展投資,」已向衛福部申請人體臨床試驗,預計今年底做完第一期,希望明年第三
、四季可以做完三期上市。
國衛院感疫所研究員劉士任表示,DNA疫苗是新一代的核酸疫苗,國際上僅有美國藥廠做完
第一期人體試驗,韓國、中國正在做第一期,「但他們都是跟美國藥廠 Inovio合作技術,
台灣是從頭到尾自己來,」劉士任透露,疫情爆發時也曾跟 Inovio尋求合作,可是台灣市
場小,沒有獲得回應,只好從頭自己來,進度沒有落後其他國家太多,他也語重心長說,
「希望在證實疫苗效果一樣好的情況下,政府能採用台灣自製疫苗。」
至於國光另一款重組蛋白疫苗,則即將展開第一期人體臨床試驗。國光生技在法說會上指
出,第一期是健康人、預計收60~70人,力拼10月提前進入第二期試驗,二期則預計擴大
收案3,000人。由於第三期所需收案人數更多、且需針對感染者,國光將和國外合作,希望
今年12月生產20~30萬劑,優先提供給醫護人員施打,明年農曆年(2021年2月12日)前量
產200~300萬劑供一般民眾,目標是明年全數試驗完成,產出2,300萬劑。
國光生技總經理留忠正接受《報導者》採訪表示,下週(8月中旬)就能進入第一期試驗,
第三期試驗會到有疫情的國家找受試者,已陸續和國外洽談;不過須待二期做完,看進展
如何,才能和國外進一步確認。
國光已和台大醫院簽署臨床試驗合作計畫,由台大副校長張上淳領銜計畫主持。然而,行
政院打算採取國外授權、由台康代工生產的模式,讓國光的布局起了變化──因為台康是
蛋白質藥廠,也替本土疫苗廠代工疫苗原液。
留忠正表示,先前的確已和台康接觸生產疫苗,但若台康接下國外疫苗生產任務,將影響
國內產能,國光可能也要找其他家業者合作。直接向國外採購疫苗成品比較單純,做代工
會影響到本土生產線,「政府太急了,可以再等1、2個月,若我們臨床試驗情況不好再和
國外談。」
站在業者的角色,他認為,「COVID-19是充實台灣生技產業很好的機會,可以理解政府希
望讓民眾有疫苗打,但應該優先支持台灣廠商,第二選擇是跟國外直接買製造好的疫苗,
最後才是國外授權、國內製造,將生產量能留給本土業者。」
疫苗研發過程要做多少臨床試驗?
疫苗研發過程大致可分為「臨床前試驗」和「臨床試驗」兩階段,後者分為三期,會依試
驗需求,逐漸擴大收案人數:
【臨床前試驗】
疫苗設計研發:根據病原體特性設計抗原,以誘發人體產生免疫反應。此次COVID-19就有
DNA疫苗、胜肽疫苗、次單位疫苗、重組病毒疫苗、奈米疫苗等不同疫苗同步開發。
動物實驗:選用適合動物、建立動物模式,觀察疫苗是否能讓動物產生良好抗體,並從攻
毒實驗上驗證其有效性。
【臨床試驗】
第一期:初探安全劑量、評估副作用,收案對象是健康民眾。
第二期:小規模測試疫苗免疫反應、測試有效性,一樣以健康民眾受試,但一般區分試驗
組和對照組進行雙盲試驗。
第三期:大規模招收高風險地區的健康民眾,測試疫苗有效性。此次COVID-19由於目前台
灣確診個案少,可能找不到足夠的受試者,須尋求國際合作。
COVID-19疫苗是史上第一次,臨床試驗和量產同步展開的疫苗。張上淳接受《報導者》專
訪時指出,若疫情嚴峻,第二期臨床試驗效果和安全性不錯,就能緊急量產,當成「戰備
疫苗」,一旦有爆發群聚感染之虞,高風險者如醫護人員優先施打,保護他們以確保國內
的醫療量能不至於崩潰。
從SARS到COVID-19都是重要抗疫成員的張上淳指出,台灣基礎研發能力夠,但應用到臨床
或者商業使用,「這個部分,看起來都是略慢一些。」
張上淳認為,台灣的廠家規模不大,平常業界的扶植不夠,市場太小。做快篩試劑的廠商
,平常就應該做其他試劑,有足夠的量產能力,臨時要研發新的試劑才能立刻上戰場,「
這是我們比較弱的地方,」這牽涉到平常政府在科技研發上的投資。
全球疫苗競賽,台灣難題在於已錯失先機
https://i.imgur.com/deaOWVc.png

國光已和台大醫院簽署臨床試驗合作計畫,由台大副校長、中央流行疫情指揮中心專家諮
詢小組召集人張上淳領銜計畫主持。他也坦承,台灣基礎研發能力夠,但應用到臨床或者
商業使用仍慢於先進國家。(攝影/陳曉威)
現實情況上,本土疫苗要在趕在年底、秋冬可能大流行之前完成二期試驗,進行小規模量
產「戰備疫苗」,中間得面對不少問題,例如疫苗的安全性和有效性。
「疫苗不會說打100人,100人都產生足夠抗體、保護力,假設只有50個有,夠不夠?」張
上淳表示,一般季節性流感疫苗每年都在施打、製造,大家很明確知道什麼樣的疫苗是好
的,但COVID-19疫苗沒有客觀標準可依循,就算有疫苗可以做到90%保護力,若疫情嚴峻
,是否要要求其他廠家都做到這樣子,或是80%、50%保護力也可以接受?這些都是未來
製造疫苗要面對的難題。
台灣大約何時有國產疫苗?張上淳保守地說,「今年內其實可能也不是那麼容易。」
國內疫苗研發牛步,前疾管局局長、國衛院名譽研究員蘇益仁憂心指出,中國去年12月爆
發疫情,1、2月武漢大流行,今年若再次流行可能也是落在這時期,最嚴重應該在2月,因
此本土疫苗研發關鍵點在12月,因為疫苗接種後要產生抗體,至少需花費一個月,台灣最
好在12月就開始打疫苗。
但蘇益仁悲觀地說,第一期臨床試驗要3個月, 本土廠商8月才開始、結束就11月了;若順
利12月做二期臨床試驗,可能得等到3月才有疫苗。「這是做完第二期而已喔,歐美已經做
完三期了,我們若做出來只能當緊急使用。」
蘇益仁指出,如果本土廠商12月完成二期試驗,可以生產「戰備疫苗」,政府向國外買的
疫苗若1、2月才到貨,這樣台灣可以先用本土疫苗應急,等國外到貨再大規模施打,「如
此可疫苗、也可以有效扶植台灣生技產業,是最理想的。」
最糟的是,在今年秋冬疫情再次爆發前,如果買不到國外疫苗,本土廠商也製造不出來,
屆時對防疫是一大考驗。就算買到國外疫苗,本土廠商製造太慢,趕不上今年秋冬疫情,
台灣雖然一樣可以應付疫情,「但是生技產業界就垮掉了。」
「很多人沒有把流行病學和全球局勢一起評估,這是台灣最大問題,」蘇益仁批評,台灣
不可能做三期試驗,因為感染者太少,一定要尋找國外受試者,但依照現在全球研發進度
,當台灣藥廠要開始做第三期試驗時,可能找不到受試者,「因為大家都打完疫苗了。」
他擔憂,要是沒搶到第一波先機,等到國際大廠都成功製造出來,疫苗恐怕會過量,台廠
更沒有生存空間。「每個大廠量產疫苗都是幾億到10億劑,若有5個大廠,全球明年中將產
生50億劑疫苗。」若本土廠商研發太慢,基於防疫安全、急迫性,政府優先採購國外疫苗
,而且國外量大,生產成本低,到時候政府招標,本土業者根本無法競爭。
政府缺乏決心:扶持動作慢半拍、法規跟不上
台灣疫苗發展遲緩,除了資金不如國際大廠,政府的態度更是箇中關鍵,不僅法規慢半拍
,也缺乏整體性思考。
7月23日衛福部公布研發疫苗補助辦法,只要在8月31日前獲食藥署核准進行一期試驗,可
以獲得2億元,12月底前核准二期測試,並在明年(2021)6月前獲得量產許可,再補3億元
。加上疫苗採購金,編列預算達135億,國內研發和國外採購同時並行。
然而這些措施看在蘇益仁眼中,慢了不只一拍,因為美國、歐洲等生技大國,早在疫情爆
發之始,就由政府帶頭投入資金研發疫苗、簡化審查流程,加速在今年完成研發。
蘇益仁曾在SARS期間擔任疾管局長,此次行政院也借重他防疫專業,聘為行政院「COVID-
19科技防疫推動會議」疫苗組召集人,當看到全球加速研發疫苗,從5月開始,他就不斷跟
政府建議,應主動協助廠商開發疫苗,給予獎勵金、簡化審查流程和受試程序等,例如規
定第二期試驗人數3,000人過多,世界衛生組織(WHO)建議僅需1,000~2,000人,應適度調
降。
直到7月8日,疫情指揮中心才公布放寬收案標準,實驗組收案1,000人、對照組300人;獎
勵辦法也是7月底才終於出爐。心灰意冷的蘇益仁7月以身體不佳為由辭去疫苗國家隊的召
集人,他無奈表示,「我們已經錯失至少3個月的黃金時期。」
蘇益仁批評,台灣政府沒有認清全球加速製造疫苗的局勢和決心,第一時間僅遵循過去做
法,要求研發廠商提供各式資料,交給政府審查,資料不全再繼續補,一週一週拖下去。
相較於美國先設定10月要製造出來的目標,食藥署(FDA)再從中輔導廠商、檢視法令有哪
些需要修改、申請資料如何簡化,由政府帶著廠商開發,「反觀我們情形,是廠商要求政
府快一點,那個態度應該要反過來,這地方是最大差異。」
SARS後經費縮減,P3動物實驗室、人才短缺
https://i.imgur.com/V3tfyTk.png

前疾管局局長、國衛院名譽研究員蘇益仁直指,「很多人沒有把流行病學和全球局勢一起
評估,這是台灣最大問題,」現階段仰賴國外疫苗是防疫考量必須做的選擇,但扶植國內
生技產業刻不容緩。(攝影/蔡耀徵)
台灣生技產業政策缺乏長遠視野,從17年前SARS至今沒有突破。「SARS結束之後,科技部
投入不少資源給學界研究,可是隨著時間過去,好像都沒有新的疫病出來,經費就遞減、
遞減、再遞減,」張上淳描述這段歷程時,只能苦笑。
身為17年前第一線抗SARS的成員,張上淳對這幾年生技研究變化很有感。在疫苗和藥物進
入人體臨床試驗前,需要先用動物試驗,確認有效性和安全性,COVID-19相關實驗都要在
「動物P3實驗室」中進行,張上淳解釋,P3實驗室可分為「細胞實驗」和「動物實驗」兩
種,前者在SARS之後,台灣一些醫院、大學其實就增設不少間,不過由於運作經費高昂,
不少實驗室後來都缺乏經費,停止運作。
此次疫情爆發時,全台只有國防醫學院、農委會家畜衛生試驗所、國衛院3處有相關設備,
中研院則約在4、5月時,疾管署加緊腳步審查,才成為第4家認證實驗室。
也曾參與國衛院COVID-19疫苗相關研發動物實驗的感疫所副研究員杜鴻運,長年從事的「
結核桿菌」研究也需在P3實驗室中操作,對P3動物實驗重要性感觸深刻。
杜鴻運估計,一間P3實驗室成本超過500萬元。他提及,早年進行肺結核相關研究時,與三
總臨床病理科合作,實驗在三總進行,當時完成國內肺結核的分子流行病學調查。不過,
「當要做毒性、甚至疫苗研究開發時,卻面臨沒有P3動物實驗室可用的窘境。」
國光和國衛院合作開發疫苗時,面對最大的問題也是動物實驗,留忠正說,疫苗須用猴子
動物實驗,「但台灣沒有猴子可供實驗,最後用倉鼠和基因轉殖老鼠替代。」
蘇益仁擔任國衛院感疫所所長時,推動蓋設該院P3動物實驗室。由於維護成本極高,一年
後因沒錢而中斷,實驗室停止運作兩年,後來新計畫接上後才又重啟,幸好和此次疫情接
軌。
就算有設備,實驗室操作人才有限也成另一問題。國衛院即在疫情爆發後啟動P3實驗室新
血培訓,補足人力缺口。
國衛院感疫所副研究員余冠儀表示,前陣子曾有廠商與國衛院接觸,希望臨床用藥在人體
試驗前,能進行動物實驗,不過按照目前排程沒辦法馬上進行,至少等到10、11月才可以
做,如果沒辦法等,廠商得找其他地方、甚至向國外單位詢問可能性。
杜鴻運回憶,當年國衛院P3實驗室中斷時,珍貴的實驗人才也因此離開。他建議,未來台
灣的P3實驗室若有國家資源支持,能扮演「平台」角色,讓全台有需要做P3動物實驗的人
都可以使用,P3動物實驗室能維持營運。
指揮中心為何不敢用國產快篩?
本土生技業「研究」與「巿場」無法銜接,連經濟部都很有感。
今年3月《報導者》報導台灣的快篩研究有大突破,工研院開發世界上最迷你PCR(iPMx分
子快速檢驗系統,簡稱疫開罐),7月6日取得專案製造核准,但經濟部內部透露,「指揮
中心至今都不打算採用,而是考慮採用國外羅氏藥廠的快篩試劑,」經濟部官員無奈透露
,當本土研發不被重視,怎麼能帶動台灣生技產業發展?該官員認為,「如果開發的產品
太差,被排除我無話可說,但完全不是這麼一回事。」
經濟部不服氣,不斷爭取「疫開罐」參與國際獨立第三方分子診斷品質管理監測機構(
Quality Control for Molecular Diagnostics, QCMD)舉辦的COVID-19 檢測能力測試,
比對試劑效能與實驗室檢測能力,結果盲測結果100%正確,比韓國43個實驗室盲測結果97
.7分還要高,工研院與經濟部在指揮中心研發組會議上提出試辦計畫,針對入境旅客進行
實驗篩檢,並比對旅客出具的陰性報告,以驗證本土快篩是否夠格?但最後仍不被指揮中
心採用,讓參與的研究人員相當灰心。
工研院生醫與醫材研究所所長林啟萬受訪時坦言,目前國產快篩正授權廠商進行1萬劑與10
台機器的試量產,若能有國內明確訂單,對於國內廠商投入量產的意願絕對會有助力,政
府是能扮演點火的角色;目前除了政府之外,也規劃企業在國外設廠的檢驗需求,尋找可
能的使用者。
中央流行疫情指揮中心這麼沒信心,一部分也是受到2010年H1N1新流感疫苗事件影響。當
年一名7歲的劉小弟弟在打完H1N1疫苗後死亡,引發軒然大波,家屬控訴是因國光生技的疫
苗造成,雖然事後法務部法醫研究所事後解剖屍體,認為和疫苗並無相關,卻已經重創民
眾、甚至政府對國產疫苗的信心。
強化本土產業的他山之石:MERS重創的韓國今轉為生技輸出國
https://i.imgur.com/frvFJaP.png

2015年中東呼吸道症候群(MERS)疫情延燒期間首爾市區的行人。韓國經MERS肆虐後,痛
下定決心發展生技產業,COVID-19時已由生技輸入國變輸出國。(攝影/AP Photo/Ahn
Young-joon/達志影像)
現階段仰賴國外疫苗是防疫考量必須做的選擇,但蘇益仁認為,扶植國內生技產業刻不容
緩,「台灣業者的研發技術不是問題,但政府要給予市場前景,而非讓業者在全球戰場上
自生自滅。」
許多國際藥廠挾著雄厚資金打市場,「你醫院跟我買診斷試劑,我就送你儀器,」蘇益仁
透露,一家專研肝炎檢測的本土業者,有很好的技術和試劑,因為資金不敵國際大廠,B型
肝炎診斷試劑市佔率僅佔台灣10%,差點倒閉。
台灣雖然加入世界貿易組織(WTO),需要開放國際藥廠來競標,但蘇益仁認為,政府仍可
以設定一定比例採購本土廠商,或仿照日本,設定嚴格的檢測敏感度、專一度採購條件,
提高競標門檻,扶植國內廠商。「現在政府心態是沒看到疫情發生在台灣前不採購,你做
好疫苗我再來買就好,最好直接從國外買現成。」
中研院生醫所兼任研究員何美鄉也認為,除了跟國外買疫苗,政府平時也要有穩定的預算
,長期投入研發,「許多看起來不重要的東西,到關鍵時刻可能很重要。」她比喻,不可
能生一個小孩,一次餵他吃幾十斤食物,就要求他一夕長到20歲,平時就要有所準備,才
能應付關鍵時刻。
以韓國為例,2015年因中東呼吸道症候群(MERS)受到重創,36人死亡,痛下定決心發展
生技產業,這次COVID-19率先開發出快篩工具,得以在疫情爆發時立即進行大規模篩檢,
甚至創造篩檢技術輸出海外,並開發出機械手臂自動化完成PCR病毒核酸檢測,開啟國際仿
效,短短幾年間,由生技輸入國變輸出國。
經濟部官員即在指揮中心研發組會議中提出,今年初韓國爆發大規模社區感染時,當時確
診高峰達909人,快篩廠商日產能已經有5,000組,到6月的日產能已經達到50萬份,1到5月
的銷售額高達3.57億美元,單單4月分出口額就暴增8倍;這與國家隊口罩政策一樣,必須
有確定收購的保證,廠商才願意24小時不斷電生產,國內對於快篩試劑沒有確定採購量,
萬一真的不幸遇到大規模社區感染,國內試劑產能不可能一夜之間突然暴增,屆時還是得
對外採購應急。
本土生技產業也是防疫一環,有全面規畫才能備戰未來
「政府很重前端學術研究,但是進到生產端時就認為是廠商自己的事情,」留忠正認為,
2009年H1N1新流感疫情時,國光也是緊急製造出疫苗,「我們不能每次都靠國外,台灣現
在前端的研究很好,但從實驗室到商業化生產這段比較弱,希望這次COVID-19可以建立一
整套制度,例如不要先授權代工英國疫苗,把生產量能優先留給國內生技廠。」
缺乏長期戰略布局,下一個病毒來襲時,台灣仍然只能在後苦苦追趕。「最重要是政府態
度,要有決心,」蘇益仁語重心長地說,從國外採購疫苗雖然方便,但新型病毒流行時,
台灣可能買不到國外疫苗,勢必要有自己開發的能力,才不用看其他國家臉色,領導者要
有遠見,用國家力量發展生技產業。
張上淳則表示,面對未知的病毒,所有國家都不敢說自己有十足把握,「我們不能單邊壓
寶。」他認為,不管是跟國外採購疫苗或本土自行研發,必須同時並進分擔風險,也要讓
資源共享,例如國衛院在這次疫情建立平台,分享不同醫院間病人的檢體資料,就是一個
很好的嘗試。
「若這次政府不支持,下次就沒人跟你玩了,」劉士任表示,國外藥廠平常就在做相關試
驗,台灣在SARS後經費縮減,因此研發進度當然比不上國外,但不能因為別人有做,台灣
就不做了;政府採購國外疫苗是建立商業上的往來關係,確保未來買賣管道順暢,重點還
是要讓本土研發技術生根,建立起長期穩定的技術平台,「不是只著重在這次疫情,急著
搶賺大錢,而是在面對未來的疾病,有更快速的反應。」若不能把握這次疫情,建立戰略
布局,長期投資研發,未來20年,台灣還是只能從頭開始研發。
後續與迴響:牛津疫苗暫停,台灣疫苗布局從授權製造轉向預購、扶植國內廠為主
(2020.9.9 更新)
疫苗研發被視為阻斷COVID-19疫情蔓延最終的武器,全球疫苗研發都加速進行,目前已有9
支疫苗率先進入「第三期臨床試驗」,其中,由牛津大學和阿斯特捷利康公司(
AstraZeneca ,簡稱AZ)合作開發的「AZD1222」是最被看好的疫苗之一,並採創新的平台
,承諾不尋求獲利,以成本價發售。
但AZ在9月8日宣布,因為一名受試者出現嚴重不良反應,全面暫停第三期臨床試驗。這也
是進入第三期人體試驗的候選疫苗中,第一支因受試者出現嚴重不良反應而暫停臨床試驗
的疫苗。
行政院於8月初透過國家衛生研究院,積極爭取這支「AZD1222」疫苗的授權在台製造,希
望可以藉此趕在今年秋冬讓民眾接種疫苗。但該疫苗傳出試驗暫停後,中央流行疫情指揮
中心指揮官、衛福部部長陳時中在例行記者會中鬆口,台灣疫苗布局已轉向,從爭取授權
製造,未來將以預購國外疫苗、申請世界衛生組織的COVAX疫苗平台,以及扶植國內生產為
主。
■「AZD1222」受試者患脊髓炎,張上淳:臨床試驗有安全疑慮,即刻暫停是常態
「AZD1222」這支原本進度領先、也極被看好的疫苗,今年7月公布的第一、二期臨床試驗
報告中,1,000名受試者中,有60%的案例出現輕微的不良反應,包括發燒、頭痛、肌肉痠
痛、注射部位疼痛等。但最新出現的「個案不明副作用」,則屬嚴重的不良反應,因而暫
停臨床試驗。
AZ發言人在聲明中表示,正在加快調查這起不良反應跟疫苗的相關性,將與牛津大學啟動
「獨立專家團隊」檢討資料,直到確認安全無虞、或導致個案不良反應的客觀原因後,才
會重啟人體試驗。
對此,指揮中心專家諮詢小組召集人張上淳表示,臨床實驗進行中的重點,就是要觀察受
試者是否會出現副作用不良反應。他指出,AZ的資料顯示,該名嚴重不良反應的受試者,
接種後出現了脊髓炎,為了安全起見全面暫停臨床試驗,是很正常的事情,應該先釐清疫
苗與疾病的關聯性後,再由專家認定是否要繼續試驗。「這個模式也適用於台灣自己的臨
床試驗。」
由於和疫情賽跑,全球疫苗都壓縮了臨床試驗時程,甚至動物試驗與人體試驗同步展開,
許多專家也憂心,疫苗安全性無法嚴格把關。台灣「冠狀病毒之父」賴明詔日前接受《報
導者》專訪時,即點出這個問題,過去疫苗從研發到臨床試驗至少要3、4年的時間,這次
短短2個月,就進入疫苗人體試驗,有些疫苗也可能對身體有毒性的,疫苗研發完不一定真
的就可以使用。
中研院基因體中心研究員馬徹表示,這次牛津大學合作開發的疫苗,是使用會感染黑猩猩
的「第五型腺病毒」來做為載體,加入新冠病毒抗原基因片段。
腺病毒是一般感冒常見的病毒,屬於毒性較低的病原體,過去科學家就曾利用會感染人類
的腺病毒來開發疫苗,但也曾發生不良反應案例。
例如1999年時,賓州大學針對一罕見疾病進行基因治療,其中一高劑量受試者出現不良反
應並死亡。2007年、2009年時,美國國家衛生研究院(NIH)合作開發的HIV疫苗,同樣使
用第五型腺病毒來作為載體,但最終以失敗收場。
馬徹表示,牛津大學選擇使用會感染黑猩猩的腺病毒,可能就有安全性的考量,不過實際
上是否比較安全,仍待實驗證實。他也強調「疫苗是給健康的人打的」,COVID-19爆發讓
人類處於前所未有的狀態,各國對於新的疫苗技術不斷衝刺,但安全與否仍需審慎實驗、
評估。
■台灣疫苗布局轉向,陳時中:授權製造會壓縮台灣產能,改為次要選擇
8月初行政院與牛津大學積極聯繫,希望申請AZ疫苗授權在台生產,如今因為AZ疫苗暫停,
是否影響目前台灣的疫苗布局?對此,陳時中表示,授權製造這條路並非完全放棄,但目
前將重點轉向預購疫苗、世界衛生組織COVAX疫苗平台授權分配以及扶植國內廠為主。
陳時中表示,授權製造的部分,國外疫苗廠要求的量都非常大,「那樣的疫苗量台灣要消
化,甚至將來拿來出售、贈送,都有相當的結餘量,況且生產量很容易就把台灣的生產量
能全部都佔滿,讓國內可以製造的量能降低。」
至於國內狀況,國光生技日前已與台大醫院簽署臨床試驗合作計畫,並由張上淳領銜計畫
。張上淳今接受《報導者》採訪僅透露,目前國光疫苗仍在第一期臨床試驗進行中。
針對疫苗布局現況,張上淳表示,台灣一直以來都是多管道去接洽,目標是提早取得疫苗
,而國際確實有幾個廠商進度較快。台灣要能優先取得疫苗,張上淳坦言很難確定是否能
買得到,「疫苗成功研發,一開始的量一定無法應付所有人,所以誰會先取得、誰能取得
足量,都還有很多因素影響。」
目前能做的,張上淳說,仍會緊盯國際的開發進度,並洽談預購時間;同時還有世界衛生
組織COVAX平台,屆時某些廠商完成疫苗研發後,可以透過此平台公平快速地分配給世界各
國。
■疫苗流程壓縮,各國搶緊急授權,陳時中:視各國疫情嚴重程度而定
陳時中表示,疫苗的發展都是以數年計算。但這一次COVID-19,疫苗要趕在一年內完成,
時間上緊縮很多。被壓縮的部分就是,臨床上會將第二、三期混做,第二期還沒結束,就
先開啟第三期。
另外,一般疫苗在試驗結束後,有一段時間的觀察期,完成觀察期後,各國才會核發藥證
。而這次各國所拼的「緊急授權」,就是在未完成觀察期,約在第三期臨床試驗階段,取
得基本的安全性、有效性之後,就可以緊急使用。「不代表完全安全,只是趕快施打,效
益可能會比沒有打疫苗來得大。」
因此,陳時中說,「緊急授權」是配合各國的疫情來選擇判斷,例如在疫情非常嚴重、一
天好幾萬個病例的地方,就能採用較快速、寬鬆的方式授權使用;而台灣的情況,對於疫
苗安全性的觀察就會拉長。
陳時中強調,現階段疫苗在製造與採購上都充滿不確定性,因此目前只能維持高度注意。
但大方向上,是台灣願意冒較大的投資風險,「意思是,現在若有疫苗,學理上專家認為
可行,我們寧願冒著可能不成功的風險也會投資;但是投資後談判交貨、保障契約履行的
部分,就會在商業上受保障去進行,現在不確定因素太多,所以隨時提高警覺。」(文/
陳潔、柯皓翔)
看完有點感覺
當初目標三路並進
但可能互有衝突還怎樣
變成三邊都沒辦法出全力去進行
最後三路並進的構想
變成現在三頭空
或許當初全壓一邊
超買一億多劑
或犧牲國產升級空間走回頭路完全靠代工
或是放手國產瘋狂補助資金人力
也會比現在狀況好
--
※ 發信站: 批踢踢實業坊(ptt.cc), 來自: 59.124.165.188 (臺灣)
※ 文章網址: https://www.ptt.cc/bbs/Gossiping/M.1623390111.A.8EB.html
→
06/11 13:42,
2年前
, 1F
06/11 13:42, 1F
→
06/11 13:45,
2年前
, 2F
06/11 13:45, 2F
推
06/11 13:46,
2年前
, 3F
06/11 13:46, 3F
推
06/11 13:48,
2年前
, 4F
06/11 13:48, 4F
噓
06/11 13:54,
2年前
, 5F
06/11 13:54, 5F
→
06/11 13:55,
2年前
, 6F
06/11 13:55, 6F
→
06/11 13:55,
2年前
, 7F
06/11 13:55, 7F
→
06/11 17:32,
2年前
, 8F
06/11 17:32, 8F
推
06/11 21:01,
2年前
, 9F
06/11 21:01, 9F
→
06/11 21:01,
2年前
, 10F
06/11 21:01, 10F
→
06/11 21:02,
2年前
, 11F
06/11 21:02, 11F
→
06/11 21:02,
2年前
, 12F
06/11 21:02, 12F
討論串 (同標題文章)